UDI系統(tǒng)建設是醫(yī)療器械監(jiān)管的重要基礎性工作,建立UDI系統(tǒng)有利于運用信息化手段實現(xiàn)對已上市產品的快速、準確識別,有利于實現(xiàn)監(jiān)管數(shù)據(jù)的整合,實現(xiàn)醫(yī)療器械全過程信息化、智能化、精細化管理,提高醫(yī)療器械的可追溯性,提升醫(yī)療器械管理水平和效能。
從2013年FDA發(fā)布全球第一個全面的UDI法規(guī)開始,很多國家和地區(qū)的監(jiān)管機構相繼啟動了UDI法規(guī)的制定工作,歐盟、巴西、土耳其、俄羅斯等均已有UDI法規(guī)出臺,在接下來幾年將陸續(xù)進入實施階段。UDI法規(guī)的全面實施涉及IT系統(tǒng)、標識系統(tǒng)、生產和售后服務系統(tǒng)、銷售管理系統(tǒng)、產品設計變更、監(jiān)管機構注冊和上市后監(jiān)管系統(tǒng)的改造和鏈接。企業(yè)需要早期介入,全面評估,做好頂層設計,打通企業(yè)內外部信息孤島,提升運營效率,促進合規(guī)。
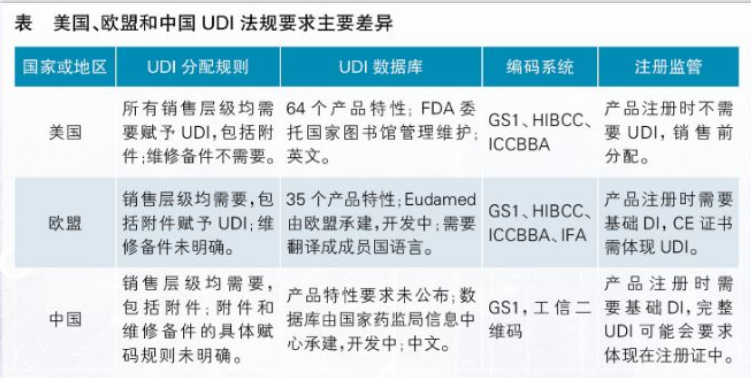
FDA的UDI法規(guī)在2013年發(fā)布,配套的UDI編碼、標識、數(shù)據(jù)庫等指南在2014年陸續(xù)出臺,目前已比較齊全。即便如此,F(xiàn)DA UDI數(shù)據(jù)庫仍存在一些問題,例如數(shù)據(jù)上傳功能經常無法使用等。FDA要求產品 UDI數(shù)據(jù)在產品注冊完成以后、銷售之前上傳。每個產品需要維護64個字段信息,很多是可選項,F(xiàn)DA沒有足夠資源或手段進行數(shù)據(jù)準確性校驗。因此,其數(shù)據(jù)庫信息的準確性存疑。FDA目前已意識到這個問題,并已開始進行這部分工作的梳理。
歐盟的UDI法規(guī)于2017年公布,其相關要求作為新的MDR和IVDR法規(guī)的一部分公布,法律地位很高。2018年底到2019年2月,歐盟公布了幾個配套的澄清性指南,真正具備操作意義的指南還未出臺。由于MDR法規(guī)是2020年5月實施,IVDR法規(guī)2022年5月實施,歐盟的UDI配套指南和數(shù)據(jù)庫建設工作還相對比較滯后。
中國UDI法規(guī)制定過程中,借鑒了很多FDA、IMDRF和歐盟UDI的法規(guī)要求。2018年12月發(fā)布了《YY/T 1630-2018醫(yī)療器械唯一標識基本要求》標準,2019年7月發(fā)布了《YY/T 1681-2019醫(yī)療器械唯一標識系統(tǒng)基礎術語》。
基于對上述法規(guī)的理解,對美國、歐盟和中國的UDI法規(guī)要求進行分析,其主要差異見下表。
各個國家和地區(qū)對于UDI的監(jiān)管均是分階段實施,按照產品風險等級,從高到低有序推進。從各個國家和地區(qū)分階段實施時間表來看,2020年到2023年將是全球UDI法規(guī)實施高峰期,企業(yè)需要在2019年完成UDI實施的分析和準備,積極投入到UDI相關的試點工作中,為全面實施做好充分準備。